澳門大學在乳腺癌研究中取得突破,發現NOTCH1蛋白激活可以促進三陰性乳腺癌的形成,針對其分子調控通路的靶向藥物可以有效阻止三陰乳腺腫瘤的生長,為這種致命疾病的臨床治療提供了有效方案。該研究成果已於國際著名期刊《自然—通訊》(Nature Communications)中發表。
澳大健康科學學院院長鄧初夏教授帶領的團隊揭示了NOTCH1促進三陰乳腺癌發生内在的分子调控通路,該機制的發現不僅解釋了此前人們對於NOTCH1到底是促癌基因還是抑癌基因的爭論,更重要的是為三陰性乳腺癌的治療提供了重要的靶點。基於上述發現,靶向藥物如ATR抑制劑和Cisplatin可以有效治療三陰乳腺癌,為這種致命疾病的臨床治療提供了有效方案。
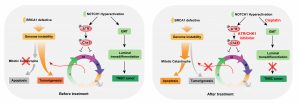
目前已有研究證實乳腺癌易感基因BRCA1(Breast cancer gene 1)是乳腺癌發病相關的最重要的基因之一,並且具有家族遺傳的特點。攜帶BRCA1基因胚性突變的女性一生中有高達87%的幾率罹患乳腺癌。BRCA1突變基因攜帶者所患的乳腺癌中,有48%-66%的患者為三陰乳腺癌。三陰乳腺癌是指不表達或低表達ER、PR及HER2的乳腺腫瘤。這類腫瘤對於激素治療耐藥,並且預後差,其惡性程度高、病程進展快,至今尚無特效藥,是臨床上公認的難題。
BRCA1在多個生物學進程中發揮著至關重要的作用,尤其是其在DNA損傷修復中的功能,因此BRCA1的缺失往往導致基因組的不穩定進而誘發細胞的死亡,而細胞一旦突破了此障礙,即可發展為腫瘤。為揭示細胞如何克服BRCA1缺失的致死性,進而發展為癌症,研究團隊採用了“睡美人”轉座子系統進行全基因組水平的驅動基因筛查。結果顯示NOTCH1排在169個潛在驅動基因的第一位。同時對人類乳腺癌患者的腫瘤數據庫分析發現,NOTCH1基因的表達水平與三陰型乳腺癌發病率緊密相關。進一步對其機制探索發現,NOTCH1在三陰型乳腺癌發生的作用中具有雙重驅動作用:首先,NOTCH1可以通過誘導上皮-間充質乾細胞轉化(Epithelial–mesenchymal transition,EMT)來促進三陰乳腺癌的發生;同時,NOTCH1可以通過一個非經典分子通路ATR-CHK1來激活細胞S/G2和G2/M周期檢驗點從而抑制BRCA1的缺失誘發的細胞死亡,利於其癌化。為進一步證實此機制,研究團隊使用靶向該通路的兩種藥物ATR抑制劑 (AZD6738)與Cisplatin協同對三陰性乳腺癌PDX(patient-derived xenograft)模型進行處理,結果顯示可以顯著抑制腫瘤的生長。該機制的發現為臨床靶向治療三陰乳腺癌提供了重要的策略。
是次研究由健康科學學院長鄧初夏教授主導,研究助理教授苗凱為文章的第一作者,副教授徐曉玲及助理教授黃冠豪亦為該研究作出重要的貢獻。相關研究獲澳門特別行政區科學技術發展基金(檔案編號:094/2015/A3,0011/2019/AKP,0034/2019/AGJ, 0048/2019/A1, 029/2017/A1, 0101/2018/A3 和111/2017/A)和澳大(檔案編號:MYRG 2016-00139-FHS和MYRG2018-00186-FHS)資助。全文可瀏覽:https://doi.org/10.1038/s41467-020-16936-9
NOTCH1促進BRCA1相關三陰乳腺癌發生的分子機制及其靶向治療
鄧初夏(右)及苗凱