澳門大學健康科學學院副教授趙琦的研究團隊和南京郵電大學材料科學與工程學院教授沈清明的研究團隊,在腫瘤微環境(TME)可激活的NIR-II光診療納米平台的開發方面取得了重要進展。他們通過簡單配位驅動的自組裝策略成功製備了TME激活的納米光學診療探針,該探針在近紅外第二窗口能通過高的腫瘤與正常組織信號比,能應用於靈敏和特異性的腫瘤診斷上,同時可產生協同的抗腫瘤治療效果。該研究已發表於國際學術期刊《Small》上。
第二近紅外窗口(NIR-II,1000-1700 nm)中的光學診療技術,能減少生物樣品的光子吸收和散射,加深組織穿透深度和具有較高的輻射最大允許暴露,因此,在腫瘤診療具有應用潛力。但目前大多數NIR-II探針處於“始終開啟”模式,由於非特異性作用,其在病變和正常組織中均會發出恒定的螢光信號,可能導致腫瘤與正常組織的信號比降低,而降低腫瘤成像的靈敏度和特異性,甚至出現“假陽性”結果。然而,非特異性的診斷和治療可能在脫靶治療期間對正常組織造成不可逆的損傷。
一些激活型NIR-II光學診療探針已經被開發出來,它們通過響應TME來精確區分病變組織與正常組織。儘管它們具有顯著的診斷特異性,但目前開發的可激活的NIR-II探針主要受限於複雜的化學合成步驟。此外,為了遞送螢光團,可能需要引入額外的組分,這可能會因賦形劑而產生副作用。因此需要開發一種簡便的方法來製備可激活的NIR-II光學系統的TME,以提高對腫瘤的診斷特異性和治療效果。
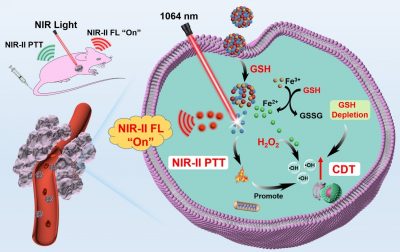
鑒於此,研究團隊基於福斯特共振能量轉移(FRET)原理開發了一種TME激活的光診療納米平台(AFD NPs)。AFD NPs是利用三價鐵(Fe(III))作為配位節點,通過硫化銀量子點(Ag2S QDs, NIR-II螢光探針)和超小半導體聚合物點(DBZ Pdots,NIR-II螢光淬滅劑)的自組裝製備得到。在正常組織中,由於Ag2S QDs和DBZ Pdots之間的FRET效應,AFD NPs能始終保持“關閉”狀態。然而,AFD NPs的NIR-II螢光信號可被腫瘤組織中過表達的谷胱甘肽(GSH)快速“開啟”,從而顯著增強腫瘤與正常組織 (T/NT) 的成像信號比,實現腫瘤特異性的診斷。此外,釋放的Pdots和還原產生的Fe(II) 離子分別提供NIR-II光熱治療(PTT)和化學動力學治療(CDT)。GSH耗竭和NIR-II PTT效果進一步加劇了CDT介導的對腫瘤的氧化損傷,實現了協同的抗腫瘤治療效果。該工作為開發激活的NIR-II光診療納米探針的TME提供了一種前景策略。
該項研究的通訊作者為趙琦和沈清明,澳大博士後戴葉能為第一作者。此項研究獲澳門科學技術發展基金(檔案編號:FDCT/0043/2021/A1和FDCT/0002/2021/AKP),國家重點研發計畫(檔案編號:2019YFA0904400)和澳門大學(檔案編號:MYRG2022-00143-FHS)資助。研究文章可瀏覽:https://onlinelibrary.wiley.com/doi/full/10.1002/smll.202206053。