澳門大學健康科學學院助理教授代雲路帶領的研究團隊設計並合成了富氧金屬多酚配位納米倍增器,將放療產生的離子化能量集中在腫瘤微環境,同時產生ROS誘導癌細胞損傷,能深層次強化抗腫瘤放療的治療效果。相關新型治療策略已刊登於國際頂級學術期刊《先進科學》(Advanced Science)。
放射療法(Radiotherapy)作為傳統的癌症治療手段,經過多年的實踐驗證,其功效已在各種類型的癌症治療中得到了認可。但是,傳統放療仍存在一定的缺陷,如高劑量射線對正常組織產生的毒性以及腫瘤微環境對放療過程中的毒性物質產生抑製作用,都限制了放療的效果。針對以上不足之處,研究團隊開發了一種富氧X射線納米倍增器:Hb@Hf-Ce6納米粒子。該納米放療倍增器將氧氣直接載入深度腫瘤組織中,在調和深度腫瘤乏氧環境的前提下提高腫瘤細胞對放療的敏感度;同時金屬多酚配位的結構將重金屬離子引入到放療的過程中,深層次強化了放療的治療效果,達到二次倍增腫瘤致死的目的。另外,PD-1抗體蛋白的引入能夠有效對遠端瘤以及腫瘤細胞的肺轉移產生抑製作用。
Hb@Hf-Ce6納米粒子基於金屬多酚配位的結構,將所有功能分子整合到納米粒子中,實現多功能抗腫瘤效果。二氫卟酚e6(Ce6)修飾的多酚結構與高原子序數放療增敏劑(鉿,Hf)配位,氧載體血紅蛋白(Hb)嵌合於配位結構中,克服與缺氧相關的耐輻射性。具體而言,在X射線輻射下,由Hf激發的放射誘導的物理過程可以啟動光敏劑Ce6,從而產生高水準ROS誘導癌細胞損傷。
在體外乳腺癌4T1細胞實驗中,結果表明Hb@Hf-Ce6納米粒子提高了放療和放動力治療誘導的腫瘤細胞死亡。此外,在小鼠原位雙邊種瘤模型中,免疫檢查點抑製劑的引入提高了放療和放動力治療引起的免疫反應,從而實現高效長時抑制腫瘤生長和轉移。因此,這種聯合治療策略誘導了針對癌症根除和轉移抑制的全面抗腫瘤免疫應答。本研究提出了一種多功能金屬多酚納米平台,可與免疫療法相結合,實現高效的X射線介導的放射治療——放動力治療,為癌症治療提供新的治療選擇。
論文《富氧金屬多酚X射線納米倍增器,用於癌症放療,放動力治療和免疫治療》的共同第一作者為博士生桑瑋及博士後研究員謝麗斯,代雲路為通訊作者。健康科學學院院長鄧初夏,博士後研究員李蓓和李傑,博士生王國浩、張展和郭森亦作出重要貢獻。此項研究由澳門特別行政區科學技術發展基金(檔案編號:0109/2018/A3 和0011/019/AKP)及澳門大學(檔案編號:SRG2018-00130-FHS)資助。文章全文可瀏覽:https://onlinelibrary.wiley.com/doi/10.1002/advs.202003338
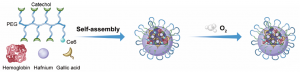
金屬多酚配位納米倍增器的合成示意圖
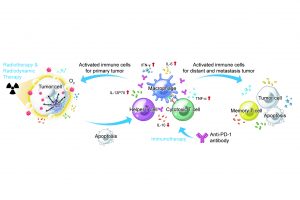
Hb@Hf-Ce6納米粒在X射線照射下啟動免疫反應

謝麗斯(右一)、代雲路(右二)、桑瑋(左一)

