全球癌症資料庫(GLOBOCAN)顯示,全球在2018年約有1,810萬癌症新發病例和960萬癌症死亡病例,當中女性乳腺癌佔210萬例,63萬人死亡,是威脅女性健康的「頭號殺手」。健康科學學院院長、癌症中心主任鄧初夏教授和高級導師陳強博士發現了抑制乳腺癌轉移和復發的新機制,為患者帶來新曙光。
研究癌症機理
鄧教授的研究團隊深入研究乳腺癌的發生發展、耐藥和轉移的分子機制,他們最新的發現,乳腺癌易感基因1(BRCA1)可以通過促進線粒體自噬和降低炎症小體的活性,抑制手術後乳腺癌的復發及轉移,成果獲著名SCI期刊《Advanced Science》作為封面文章刊登,為治療三陰性乳腺癌(Triplenegative breast cancer,簡稱TNBC)開拓新方向。研究由鄧初夏教授、徐曉玲副教授、陳強博士(第一作者)等共同完成。
作為生命科學領域頂級美籍華人科學家,鄧教授過去20多年來研究乳腺癌的發病機制和治療方法,發表論文380多篇。他表示,乳腺癌在總體癌症的發病率非常高,威脅全球女性健康。「澳大癌症研究領域較廣,涉及多種癌症,而我們實驗室盯住在女性當中發病最高的來做研究,聚焦突變時提高患乳腺癌風險的抑癌基因BRCA1,並在研究『三陰性乳腺癌』致癌機理上取得成果。」
治療三陰性乳腺癌
按臨床病理分型,在所有乳腺癌個案中,約有10%至20%屬於三陰性乳腺癌。「三陰性」指癌細胞對雌激素受體(ER)、孕酮受體(PR)、上皮生長素因子(HER2)都呈陰性。我們可以採用荷爾蒙治療ER和PR陽性的乳腺癌,以及使用抗HER2的標靶治療來應對HER2誘發的乳腺癌,但是三陰性乳腺癌目前尚無有效的靶向藥物。
鄧教授表示,三陰性乳腺癌一直被視為最棘手、最難根治的乳癌,不僅比一般乳腺癌早發病、惡性程度較高, 癌細胞也較容易轉移淋巴結,同時很快擴散,因此死亡率較高。「即使經過化療和乳房切除手術,三陰性乳腺癌首五年內復發風險仍較高,因為手術往往會刺激整個機體的免疫,釋放一些促進生長的因素令癌細胞復發和轉移,當務之急是為三陰性乳腺癌治療找到新的有效標靶。」
導致遺傳型乳腺癌的元兇
BRCA1基因具有重要的抑癌作用,能抑制惡性腫瘤,突變時卻容易提高患乳腺癌的風險。鄧教授表示,BRCA1也是導致遺傳型乳腺癌的元兇,並且多數為三陰性乳腺癌。他們在小鼠模型中證實,BRCA1在線粒體自噬、線粒體動力學方面具重要調控作用,可以通過促進線粒體自噬清除有損傷的線粒體,以及降低炎症小體活性,抑制手術後乳腺癌的復發及轉移
今次研究發現,BRCA1在細胞核和細胞質中發揮不同作用,能令線粒體維持正常自我修復的功能(如分裂、融合及自噬),對細胞健康至關重要。不過,當BRCA1發生突變或變異時,就會影響乳腺細胞中線粒體的正常運作。
陳強博士解釋指,這時候乳腺細胞出問題,是因為裏面線粒體的自噬功能會漸漸緩慢,令原本需要清除的受損線粒體大量積累,同時增加了活性氧,激發炎症小體的活性。他說:「這個過程會誘發腫瘤相關巨噬細胞的募集,抑制CD8+T細胞的活性,從而令腫瘤的免疫微環境發生改變,促進腫瘤發生和轉移。因此,採用炎症小體抑制劑如Glibenclamide(格列本脲)等,可以有效緩解因為BRCA1突變而誘發的乳腺癌的復發和轉移,這為治療三陰性乳腺癌開拓了新方向。」
精準對症治病
所有癌症都有機會轉移和復發,情況因人而異。鄧教授補充指出,有些人在手術前或癌症初期腫瘤就發生轉移,有些人則是在手術後促進了細胞激素、生長因子和炎症因子的表達,刺激腫瘤的生長,令癌症復發。鄧教授強調,只有以癌症病患為軸心,透過檢測和分析癌症基因的特徵,發掘其致癌機理,才能精確對症下藥,這就是愈趨普及的精準醫療,也是澳大生物醫學一直努力的研究方向。
未來五年,鄧教授將帶領研究癌症的團隊,構建澳門及周邊地區幾種高發腫瘤的生物庫,並繼續針對乳腺癌、鼻咽癌、大腸癌、肝癌和肺癌等的突變基因,進行更多致癌機理及預防治療的研究。與此同時,他們以精準醫療方法,研究癌症驅動基因的作用機理,以及開展癌症個性化治療。他說:「澳大的研究經驗不僅可以服務澳門,也可推廣到整個粵港澳大灣區,貢獻人類健康。」
來源:《澳大新語》第22期
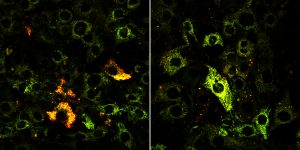
左圖是BRCA1野生型組,右圖是BRCA1缺失組。

研究成果獲國際著名SCI期刊《Advanced Science》作為封面文章刊登

鄧初夏教授2014年起出任健康科學學院院長。在1995至2014年於美國國立衛生研究院任終身研究員和遺傳研究室主任。長期深入研究乳腺癌的發生發展、耐藥和轉移的分子機制,已發表SCI期刊論文380餘篇。

陳強博士是健康科學學院高級導師,主要研究癌症發展及代謝疾病等。他從廈門大學細胞生物學專業哲學博士學位畢業,曾在美國國立衛生研究院進行博士後培訓。

