澳門大學健康科學學院助理教授明晨、廈門大學教授趙穎俊及空軍軍醫大學唐都醫院神經內科副教授張巍的研究團隊在阿爾茲海默病(Alzheimer’s disease, AD)研究取得突破性進展,開發出一種有效且副作用較小的阿爾茲海默病療法。相關研究已在神經科學頂級期刊《神經元》(Neuron)上刊登。
AD是最常見的癡呆形式,約占癡呆症病例的60-70%,在老年人口中是一個主要的致命疾病。其病理特徵包括澱粉樣斑塊、神經纖維纏結(NFT)、神經元丟失引起的腦萎縮等。目前市面上的AD治療藥物只能適度緩解認知障礙,無法阻止腦萎縮和神經元丟失。研究團隊發現,某些磷酸化tau(p-tau)形式(如p-tau181和p-tau217)在AD早期就明顯增加,並可作為早期診斷的生物標記,但其在AD發展中的具體作用仍不明確。
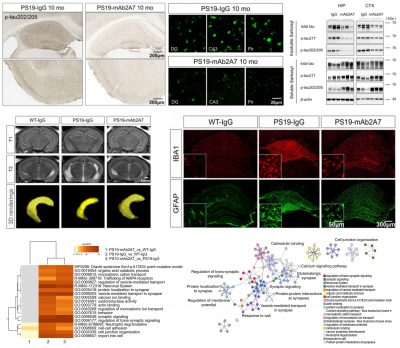
研究團隊篩選出特異性、高親和力結合p-tau217的抗體mAb2A7,發現該抗體能在AD患者腦組織切片中檢測到神經纖維纏結、神經纖維絲和Aβ斑塊周圍的病理。通過單分子免疫檢測技術(SMID),研究人員發現與非癡呆對照組相比,p-tau217在AD患者的腦脊液和血漿中升高。進一步分析發現,AD患者腦脊液中p-tau217水平與其海馬萎縮及認知損傷正相關,與Aβ42/Aβ40的比值呈明顯負相關。這些結果表明p-tau217與AD的神經退行性病變及澱粉樣變密切相關,提示其可能是干預AD神經退變的靶點。
研究人員對抗體給藥的途徑進行探索,結果發現鼻腔給藥能更高效的將抗體遞送進入小鼠大腦,並使其更有效的與靶蛋白結合。通過一系列的動物實驗和生化實驗驗證明了p-tau217是干預AD神經退行性病變的潛在靶點,靶向p-tau217的被動免疫治療是一種干預AD神經退變的行之有效且副作用較小的潛在治療策略,為AD防治提供了新的思路。定量蛋白質組學分析結果進一步顯示,mAb2A7治療主要通過上調突觸和神經元功能相關通路的蛋白表達,以及下調氧化應激及凋亡相關通路的蛋白表達,恢復了PS19小鼠大腦中的蛋白穩態。這些發現強調了恢復蛋白質穩態在AD治療中的重要性。
研究強調的是靶向磷酸化tau蛋白治療AD的潛力,且相對靶向p-tau217,靶向總tau具有更小的副作用。研究揭示p-tau217在tau病理發生和神經變性中發揮關鍵作用,並開發了一種有效且副作用較低的潛在AD免疫治療策略。研究成果在生物學領域備受矚目,已被《科技日報》、《廈門日報》、Alzforum、《遺傳》等雜誌報導,以及在BioArt、生物探索等眾多知名生物學??的社交平台上被廣泛討論。
明晨、張巍、廈門大學博士後張登虹和碩士生高旭恒為共同第一作者,趙穎俊為通訊作者。廈門大學教授張雲武和張天英,重慶醫科大學教授王超,廈門大學附屬第一醫院教授王占祥及博士生袁輝龍、毛欣茹、王春萍、邵琳、林志豪等做出了重要貢獻。研究團隊特別感謝廈門大學神經科學研究所創始人許華曦教授在研究初期提供的寶貴建議和悉心指導,以及協和腦庫和浙江大學腦庫為研究提供了重要的患者樣本。該研究由澳門大學(檔案編號:SRG2023-00003-FHS)資助。原文可瀏覽https://www.cell.com/neuron/fulltext/S0896-6273(24)00127-2。