由澳門大學健康科學學院教授羅茜領導的研究團隊,揭示了三陰性乳腺癌(TNBC)惡性進展的突破性機制,為靶向治療開闢了新方向。研究首次發現,前蛋白轉化酶枯草溶菌素9(PCSK9)通過耗竭細胞膜膽固醇水平,激活致癌信號通路驅動TNBC進展。該突破性成果表明,抑制PCSK9或其下游效應可顯著抑制TNBC腫瘤生長與轉移,相關研究已發表於國際頂級期刊《先進科學》。
TNBC因缺乏雌激素受體、孕激素受體及HER2表達,是乳腺癌中侵襲性最強、治療選擇最有限的亞型,且轉移率極高。儘管膽固醇代謝與癌症進展相關,但作為膽固醇穩態關鍵調控因子的PCSK9,其在TNBC中的作用機制此前尚未明確。
團隊通過向小鼠注射親本MDA-MB-231細胞,從其肺轉移瘤中分離出高轉移性TNBC細胞(4-11)。RNA測序顯示,轉移性細胞中PCSK9表達顯著上調。實驗證實,基因沉默PCSK9可使腫瘤生長和轉移大幅減少,而過表達PCSK9則顯著增強惡性表型。
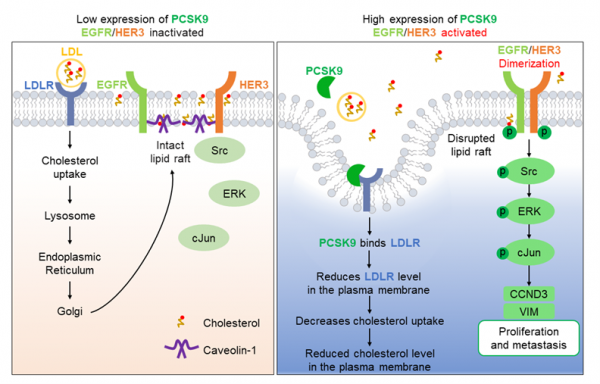
機製研究表明,PCSK9通過與低密度脂蛋白受體(LDLR)結合,減少膽固醇攝取,導致細胞膜膽固醇耗竭。這種膽固醇缺失會破壞脂筏結構,促使EGFR和HER3受體激活,進而驅動Src/ERK/c-Jun信號級聯反應,上調細胞週期蛋白D3和波形蛋白表達,最終促進腫瘤增殖與轉移。研究團隊通過使用靶向EGFR/HER3及相關下游激酶的抑制劑與激動劑,驗證了該信號傳導軸,確鑿證實了PCSK9驅動的惡性腫瘤行為的核心作用。值得注意的是,人工耗竭膜膽固醇或LDLR可產生類似促轉移效應,證實脂筏破壞是致癌通路激活的關鍵觸發因素。臨床數據分析進一步揭示,PCSK9高表達的TNBC患者生存預後顯著更差。該研究通過整合細胞生物化學與臨床證據,為TNBC精準治療提供了全新策略。
羅茜為該研究的通訊作者,健康科學學院博士畢業生李天紅及吳仁飛分別為第一作者及第二作者。本研究獲澳門特別行政區科學技術發展基金(檔案編號:0147/2020/A3和0004/2021/AKP)及教育部澳門大學精準腫瘤學前沿科學中心(檔案編號:SP2021-00001-FSCPO和SP2023-00001-FSCPO)資助。論文全文詳見:https://doi.org/10.1002/advs.202408514.