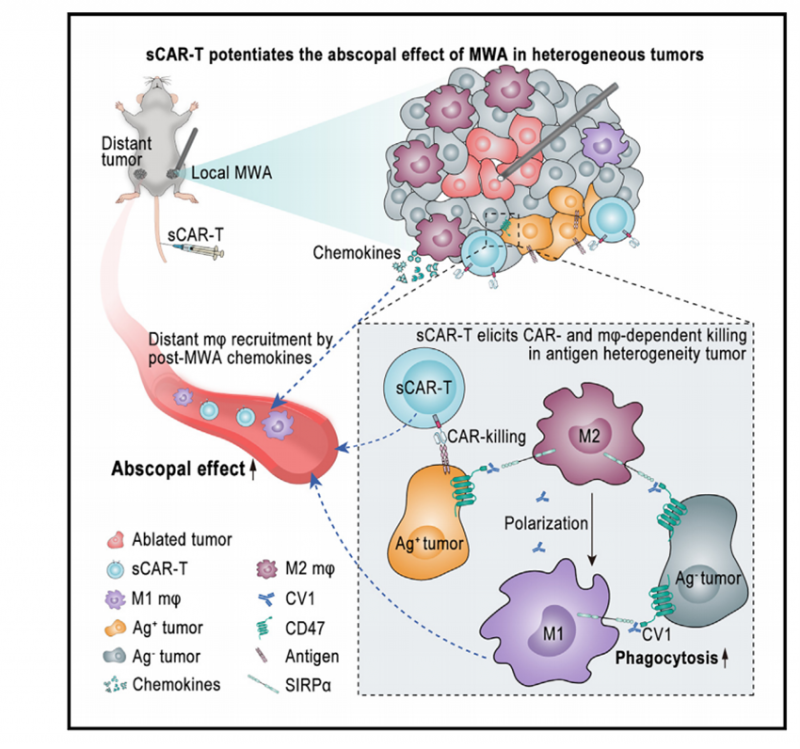
澳門大學健康科學學院副教授趙琦的研究團隊聯合廣州醫科大學教授朱康順的研究團隊,在腫瘤免疫研究領域取得重大突破。該研究成功開發了一種能夠分泌SIRPα變體CV1的新型CAR-T細胞(sCAR-T),並結合微波消融(MWA)技術,顯著增強對肝癌遠處轉移的治療效果,為廣大肝癌患者帶來新希望。相關研究成果在國際細胞免疫領域備受矚目,已發表於《細胞》雜誌子刊《細胞報告醫學》(Cell Reports Medicine)。
微波消融等熱消融技術通過醫學影像設備引導,利用局部高溫實現肝癌的原位滅活。因其療效顯著且創傷性小,被多項海內外臨床指南推薦用於肝癌治療。然而,消融後復發率較高,嚴重影響患者的遠期生存率。研究表明,微波消融可激發全身免疫反應以控制轉移或殘留腫瘤,即所謂的“遠隔效應”。但該效應通常較弱且持續時間短,難以有效殺傷腫瘤。此前研究發現,將消融技術與嵌合抗原受體T細胞(CAR-T)療法相結合,雖能有效抑制遠隔腫瘤生長,但此方法對靶抗原均質腫瘤效果較佳,而對抗原異質性腫瘤作用有限。
針對這一難題,研究團隊設計並構建了可分泌SIRPα(CV1)的sCAR-T細胞。該新型CAR-T細胞不僅具有高親和力,還能特異性阻斷肝癌中限制巨噬細胞吞噬功能的“別吃我”(CD47-SIRPα)信號通路。研究表明,在聯合微波消融治療時,sCAR-T細胞可顯著增強對遠隔抗原異質性腫瘤的殺傷作用。而sCAR-T細胞在靶向殺傷腫瘤的同時,其分泌的CV1可阻斷CD47-SIRPα通路,激發浸潤巨噬細胞的抗腫瘤活性,進而殺傷抗原陰性或低水平表達的肝癌細胞。在包含肝癌在內的多種臨床前動物模型中,使用sCAR-T細胞治療可顯著增強微波消融誘導的局部和遠隔抗腫瘤免疫效應,有效抑制術後腫瘤復發及轉移。該研究結果為肝癌患者提供了全新的綜合治療方案,極具臨床應用潛力。此項研究成果展現了為未來腫瘤免疫治療的研究與應用開拓了新的方向。
該研究通訊作者為趙琦和朱康順。該項目由澳門特別行政區科學技術發展基金(檔案編號:0009/2023/RIC和0010/2023/AKP)和澳門大學(檔案編號:MYRG-GRG2023-00158-FHS-UMDF和MYRG-GRG2024-00172-FHS)資助。全文可瀏覽:https://doi.org/10.1016/j.xcrm.2025.101965。