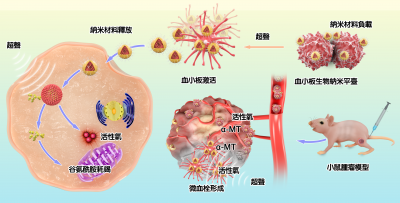
澳門大學健康科學學院副教授張宣軍帶領的團隊研發了具有超聲響應性的血小板納米藥物遞送平台,能顯著提高納米材料向腫瘤部位的有效聚集,並干擾腫瘤細胞的谷氨酰胺代謝和阻斷腫瘤血液供應,從而實現高效的超聲動力協同腫瘤治療。研究成果已發表於國際生物醫學材料領域頂級期刊《生物活性材料》(Bioactive Materials)。
超聲動力治療(SDT)是一種無創且精準的新型腫瘤治療方法,具備無輻射、組織穿透性高、可重複性強、毒性副作用小等優勢。超聲激活聲敏劑產生大量高能活性氧分子,誘導細胞氧化應激損傷,介導腫瘤細胞凋亡。然而,部分腫瘤細胞特有的谷氨酰胺成癮特性及內部高濃度穀胱甘肽會降低超聲動力對腫瘤的治療效果。此外,聲敏藥物的脫靶效應不僅降低SDT效果,還會對正常組織產生一定的毒副作用。
鑑於此,研究團隊研發了一種具有天然腫瘤靶向性的血小板藥物遞送平台高效遞送聲敏劑至腫瘤部位,實現精準的腫瘤超聲動力協同治療。血小板細胞通過其固有的腫瘤微環境趨向性可以向腫瘤傷口處主動靶向聚集,並在超聲刺激下發生形態學改變,進而在腫瘤部位靶向釋放納米材料。基於卟啉金屬有機框架納米材料內部攜帶的氨基酸轉運蛋白阻斷因子和表面塗覆的二氧化錳外殼可以有效干擾腫瘤細胞谷氨酰胺代謝和消耗細胞內部的穀胱甘肽,通過誘導氨基酸飢餓,抑制mTOR信號通路和介導鐵死亡顯著增敏超聲動力治療的腫瘤抑制效應。此外,血小板細胞在活性氧刺激下發生功能性改變,由循環血小板演變為樹突狀血小板,並在腫瘤部位伸出偽足發生交叉聚集和形成微血栓,有效阻斷腫瘤血液供應,進一步協同增強腫瘤治療效果。該載藥活細胞生物納米平台展示了一種創新型仿生設計策略來提高腫瘤超聲治療效率,為協同消融難治性腫瘤提供了新的思路。
該項研究的通訊作者為張宣軍和上海大學生命科學學院教授陳雨,第一作者為澳門大學健康科學學院研究助理教授周立強。此項研究獲得澳門科學技術發展基金(檔案編號:0114/2019/A2和0085/2020/A2)和澳門大學(檔案編號:MYRG2020-00130-FHS)的資助。研究文章全文可瀏覽
https://www.sciencedirect.com/science/article/pii/S2452199X22004844?via=ihub