澳門大學健康科學學院院長鄧初夏帶領的團隊在乳腺癌研究上取得了重大進展,該研究探索了乳腺癌發生和發展的新機制。團隊針對這一機制探索了新的用藥方案,為乳腺癌治療帶來喜訊。相關科研成果在腫瘤研究領域備受矚目,並已獲國際知名期刊《科學進展》(Science Advances)刊登。
乳腺癌是由多基因突變累計引發的複雜疾病,既往研究發現BRCA1、BRCA2、p53、CHK2、53BP1等基因都參與了癌變過程。其中,BRCA1是乳腺癌的關鍵腫瘤抑製因子。傳統遺傳學方法只能逐個檢測候選基因,時間和物料成本較高。為了能在同一生物壓力下比較更多的基因對於癌症發生的貢獻,研究團隊將睡美人(Sleeping Beauty)轉座子系統(SB+;T2Onc3+)引入Cre-LoxP介導的BRCA1條件型敲除的乳腺癌小鼠模型(Brca1 Flox11/Flox11;MMTV-Cre和Brca1Flox11/Flox11;Wap-Cre)中,進行了無差別的體內篩選。在鑒定出的169個候選基因中,結果發現CUL5在列表中排名第4位。作為腫瘤抑製因子,CUL5的敲除增強了BRCA1缺失的相關腫瘤發生。同時,該結果在CRISPR-Cas9介導的全基因組文庫篩選系統中也得到了平行驗證。
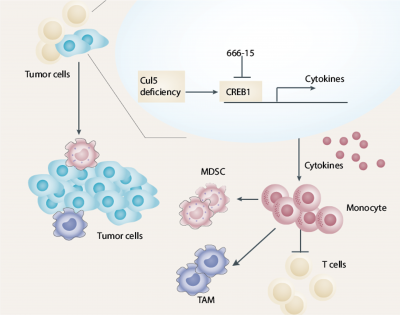
值得注意的是,CUL5的敲除對於乳腺癌細胞系的生長和增殖沒有明顯的影響,但對於體內的腫瘤生長有十分顯著的促進作用。BALB/c-4T1和BALB/c-EMT6小鼠模型實驗提示CUL5對於腫瘤的影響主要通過TME調節。CUL5缺失激活了CREB1-CCL2信號通路,導致先天免疫系統中的單核細胞(monocytes)和多形核髓樣來源抑製細胞(P-MDSC)積累,T細胞減少,最終導致了腫瘤的發生和進展。其重要下游因子,CREB1和CCL2也參與到了TME過程中。CUL5作為泛素化連接酶,可以泛素化CREB1,在常規和應激條件下降解CREB1以抑製腫瘤發生。CUL5的缺失會放任CREB1-CCL2通路活化,打破TME的平衡,導致腫瘤生長。
在臨床病例中,乳腺癌患者的CUL5通常表達下調或失活,治療此類患者最直接的方法是使用CUL5的激動劑,但目前尚無效果較好的CUL5激動劑。研究團隊目標靶點下移到其關鍵下游蛋白CREB1,用特異性抑製劑666-15抑製CREB1的活性,達到抑製腫瘤生長的目的。綜上所述,本研究揭示了CUL5對於乳腺癌發生和發展的關鍵性作用。團隊通過腫瘤免疫學的研究,探索了新的乳腺癌用藥方案。他們確定了CREB1的特異性抑製劑666-15對於治療CUL5缺失的乳腺癌模型具有積極意義,為乳腺癌的臨床治療提供了早期的新思路。
是次研究的通訊作者為鄧初夏,其博士生陳思為第一作者。澳門大學健康科學學院副教授徐曉玲和助理教授苗凱、博士後邵方元、博士研究生曾健明和郭森,亦對該研究做出了重要貢獻。該研究得到澳門大學健康科學學院講座教授沈漢明、中科院上海生化與細胞所研究員高大明的指導和幫助;澳門大學健康科學學院基因組學、生物信息學及單細胞分析核心實驗中心、動物研究核心實驗中心等亦為研究提供了大力支持。該項目由澳門特別行政區科學技術發展基金(檔案編號:111/2017/A、0011/2019/AKP、0004/2021/AKP、0048/2019/A1、0112/2019/A2、0065/2021/A 和 0034/2019/AGJ)、澳門大學(檔案編號:CPG2022-00002-FHS和MYRG2022-00181-FHS)和中國國家自然基金(檔案編號:82030094和81602587)資助。研究文章的完整版本可瀏覽https://www.science.org/doi/10.1126/sciadv.abq1395。