澳門大學健康科學學院教授羅茜帶領的團隊在腫瘤轉移機制研究上取得了重大進展。該研究發現,在血液循環中,血管剪切力(SS)通過驅動胰蛋白酶3(PRSS3)對蛋白酶激活受體2(PAR2)的切割激活,從而促進循環肺癌細胞的侵襲和轉移,這一發現為開發針對腫瘤轉移的抗癌療法提供了新思路。該項研究成果已在國際知名期刊《先進科學》(Advanced Science)上發表。
循環腫瘤細胞指從實體腫瘤脫落進入人體循環系統的腫瘤細胞,這些細胞被認為是腫瘤轉移的起源,隨著血液循環可去到各個部位形成轉移灶。在血管中,血液流動產生的流體剪切力被證實對循環腫瘤細胞具有殺傷作用,但與此同時也促進了循環腫瘤細胞的侵襲和轉移能力。然而,在體外模擬循環系統中,腫瘤細胞同時受到懸浮狀態和流體剪切力的影響,並且懸浮狀態被證明可以增強腫瘤細胞的轉移能力,而流體剪切力對循環腫瘤細胞的特異性作用以及作用機制尚未明確。
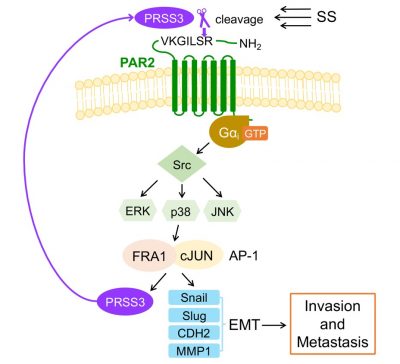
為探究流體剪切力的特異性作用,研究團隊利用自主研發的微流體循環系統模擬血液循環,生成相當於動脈水平的流體剪切力,並對循環肺癌細胞與懸浮細胞進行了一系列比較。懸浮狀態下,細胞活性幾乎不受影響;在流體剪切力的作用下,僅有約一半的腫瘤細胞可以存活,但相比於懸浮細胞,這些細胞表現出了更強的侵襲能力。轉錄組測序結果顯示,胰蛋白酶3 (PRSS3)、蛋白酶激活受體2 (PAR2)和轉錄因子激活蛋白1 (AP-1)的亞基, FOSL1的水平在循環腫瘤細胞中顯著上調,其中PRSS3和FOSL1升高超過10倍,PAR2升高5倍。敲低和過表達後的體內外實驗證明,這三個基因的高表達對於增強循環腫瘤細胞的侵襲和轉移能力起到關鍵作用。通過進一步的機制研究發現流體剪切力可以觸發PRSS3在2小時內切割PAR2的N端抑制性結構域,從而激活G蛋白偶聯受體PAR2。接下來,PAR2激活Gαi蛋白,啓動Src-ERK/p38/JNK-FRA1/cJUN信號通路,促進EMT標誌物和PRSS3的表達,最終增強腫瘤細胞的侵襲和轉移能力。此外,高水平的PRSS3、PAR2和FOSL1與較短的肺癌患者存活期相關聯,而在肺癌患者的腫瘤樣本中這些蛋白的高表達也進一步揭示了它們的臨床應用意義。該研究表明,PAR2很可能作為一種對流體剪切力有特異性反饋的機械傳感器,在循環中被PRSS3切割激活,從而促進循環腫瘤細胞的侵襲和轉移,這為靶向具有形成轉移灶潛能的循環腫瘤細胞提供了新的見解。
是次研究的通訊作者為羅茜教授,其博士生周牧涯為第一作者,博士生黎扣扣為第二作者。該項目由澳門特別行政區科學技術發展基金(檔案編號:0147/2020/A3和0004/2021/AKP)、澳門大學(檔案編號:MYRG2018-00092-FHS)和澳門大學精準腫瘤學前沿科學中心(檔案編號:(SP2021-00001-FSCPO and SP2023-00001-FSCPO)資助。全文可瀏覽:https://doi.org/10.1002/advs.202301059。