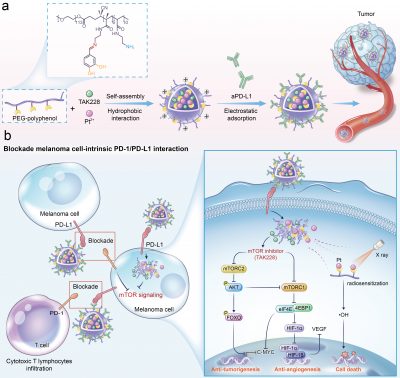
澳門大學健康科學學院副教授代云路帶領的團隊在抗惡性黑色素瘤治療上取得了新的突破與進展。該研究利用功能一體化金屬多酚納米粒子同時阻斷黑色素瘤細胞間促腫瘤生成作用並實現放射治療抗腫瘤療效的提高,最終喚醒機體抗腫瘤免疫實現最大強度的腫瘤清除。這為惡性黑色素瘤患者的臨床治療提供了新思路。相關研究成果已刊登在生物材料領域國際知名期刊《生物活性材料》(Bioactive Materials)上。
惡性黑色素瘤由於mTOR過度激活促進腫瘤發生、血管生成和放射抗性從而具有高度侵襲性和易轉移性,嚴重威脅人類健康。為構建根除惡性黑色素瘤的有效策略,代云路副教授團隊利用金屬多酚納米系統將放射增敏劑鉑離子和mTOR抑製劑同時包封,然後通過靜電吸附將抗PD-L1抗體吸附在納米粒子外層,實現黑色素瘤的精準靶向和腫瘤細胞間相互作用的阻斷。兩親性聚合物的亞胺鍵賦予該金屬多酚納米系統pH響應性能,可在酸性腫瘤微環境中快速釋放藥物。釋放的 mTOR 抑製劑 TAK228 通過抑制促腫瘤 mTOR 通路干預黑色素瘤細胞內在的 PD-1/PD-L1 相互作用,這有助於阻止 mTOR/AKT/cMYC 軸調節的腫瘤發生和 mTORC1/HIF-1α/VEGF軸調節的血管生成信號來抑制腫瘤的生長和轉移。此外,mTOR抑制有利於緩解放射抗性。因此,放射增敏劑鉑致敏的放射治療被聯合起來殺死腫瘤並誘導強大的抗腫瘤免疫。最後小鼠體內抗腫瘤效果及免疫檢測結果表明,該精準靶向治療的特異性金屬多酚納米體係可擊破黑色素瘤的增殖與侵襲特性並聯合放療增敏召喚出強大的抗腫瘤免疫來持續清除黑色素瘤。
該研究的通訊作者為澳門大學健康科學學院副教授代云路,其博士生李文曦與顏潔為共同第一作者。該組博士生田浩、王國浩等,博士後李蓓以及基因組學、生物信息學及單細胞分析核心實驗中心和蛋白質組學、代謝組學及藥物開發核心實驗中心的成員也對這項研究做出了重要的貢獻。該研究獲得了國家自然科學基金(NSFC 32171318 和 32101069)、澳門大學健康科學學院(編號: SRG2018-00130-FHS)、澳門特別行政區科技發展基金(編號:0109/2018/A3、0011/ 2019/AKP、0113/2019/A2、0103/2021/A、0002/2021/AKP)和深圳市科技創新委員會,深港澳科技計劃C(編號SGDX20201103093600004)的支持。此研究文章可於期刊官網上瀏覽https://doi.org/10.1016/j.bioactmat.2022.09.006。