八年前,澳門大學啟動精準腫瘤醫學的研究,匯聚從世界各地聘請的頂尖學者,攻克常見多發腫瘤疾病的重大棘手課題,並取得了多項創新成果。2020年12月31日,澳大獲批建設「國家教育部澳大精準腫瘤學前沿科學中心」,為國家在港澳地區佈局的首個前沿科學中心,致力引領生命科學、醫學,尤其是癌症等方面的研究與發展,目前已完成多項前期研究平台建設,並與本澳及內地醫院展開合作,為構建國際領先的精準醫學科學平台打下基礎。
全國唯一精準腫瘤學前沿科學中心
國家教育部正積極依託「雙一流」高校的學科優勢,建設世界領先的科研大平台,其中獲教育部批准在關鍵領域成立前沿科學中心的「雙一流」高校包括清華大學、北京大學等。
澳大在2013年成立健康科學學院,並結合跨學科研究團隊,重點開展癌症研究和醫療保健產業研究。澳大團隊在原創性基礎研究,不斷發表突破性的成果,不但備受學術界關注和認同,更獲得國家肯定和重視。
國家教育部批准澳大成立的「精準腫瘤學前沿科學中心」(以下簡稱前沿科學中心),是全國唯一一個教育部批准組建的精準腫瘤學領域的前沿科學中心,標誌著澳大在國家重大基礎研究平台建設方面取得突破性進展,也標誌著澳大在精準醫學領域的耕耘邁上了新台階。
前沿科學中心以健康科學學院牽頭組建,集合中華醫藥研究院、應用物理及材料工程研究院及科技學院的癌症研究力量形成高水準、國際化的團隊,以前沿科學問題為牽引,帶領開展具前瞻性、戰略性的癌症基礎研究,並把取得突破性進展的成果發表在影響指數(Impact Factor)較高的國際核心期刊,引起國際醫學界關注。
為建設國際領先的精準醫學科學平台,前沿科學中心已完成前期多項研究平台的建設,包括癌症樣本庫和血液庫、多組學技術、大數據分析、高通量藥物篩選研發、藥敏試驗、生物納米材料以及模式動物等,並與本澳及內地醫院合作。生命科學領域頂級美籍華人科學家、國際知名癌症研究專家、健康科學學院院長鄧初夏教授表示,前沿科學中心將為粵港澳大灣區乃至全國的癌症患者群提供精準診斷治療,促進大健康發展,並致力建設成為在相關領域具國際「領跑者」地位的創新中心和人才搖籃。
四方向攻克腫瘤難題
據國際醫學期刊《柳葉刀》的數據顯示,2020年中國有457萬新發癌症患者,佔全球23.7%,死亡病例300萬,癌症新發和死亡人數全球第一。澳門統計暨普查局資料顯示,2020年澳門死於惡性腫瘤的人數最多,佔總死亡人數的38.5%。
鄧初夏教授表示,常見、高發的癌症疾病,是澳大腫瘤研究攻關的重中之重。團隊在過往研究以乳腺癌為主的基礎上,目前適當拓展至其它多發的腸癌、肺癌和肝癌的預防、發生、轉移、耐藥等重大問題,通過對相關科學問題的深度研究,大幅提高癌症的診療水平。
目前,前沿科學中心圍繞癌症的發生與發展、腫瘤微環境與免疫調控、癌症轉移及耐藥機制、高效藥物開發及癌症個體化治療四個關鍵方向開展工作。第一個方向的重點在於腫瘤的早期診斷,及早把癌症鑒定出來,提高治療效率。鄧初夏教授指出,由於澳門具有遺傳背景相對單純的漢族人口聚居,而且人均壽命位列世界前三,因此澳門具有成為大人群癌症遺傳學研究物件的資源,團隊將基於澳門人群,建立人群研究的大隊列,以提高癌症早期診斷的準確率,預防遺傳性突變所致的癌症。
鄧初夏教授表示,第二個方向是當前癌症研究的熱點,腫瘤微環境是腫瘤細胞賴以生存和發展的內環境,團隊透過干預腫瘤微環境內的免疫細胞,抑制癌症發展,提高對腫瘤細胞的殺傷力;第三個方向是癌症研究的難題,絕大多數的腫瘤在一段時間後會產生耐藥,而絕大多數的病亡案例與癌症轉移有關;第四個方向是提高癌症療效,為個性化治療提供支撑。「傳統癌症療法採用『一刀切』,統一要求患者接受多輪、傷身的藥物和放射治療,我們把精準腫瘤學作為我們的首要目標,通過精準治療,對每一個個體根據他的情況來進行治療,這不僅可以避免浪費資源,更可以避免以生命為代價付出的成本。」
精準治療乳癌見成效
乳腺癌現為全球發病率最高的惡性腫瘤,復發和轉移是導致患者死亡的主因,尚未有高效的精準治療策略。鄧初夏教授與陳平研究員帶領團隊,聯合澳門鏡湖醫院、仁伯爵綜合醫院、西南醫科大學附屬醫院、中山大學附屬第一醫院、中山大學附屬腫瘤醫院和珠海市人民醫院的團隊,運用腫瘤類器官培養、體外藥敏篩查等研究手段,為不同乳腺癌患者、尤其是晚期患者提供個體化治療指導建議,治療效果良好。
團隊透過利用患者的腫瘤標本,在體外培養了99例類器官模型,並建立體外快速藥敏篩選平台。研究結果表明,體外培養的類器官模型能較好保留原始腫瘤的生物學特徵,來自不同患者腫瘤的類器官對藥敏檢測結果存在明顯差異。通過分析患者過往臨床治療的回顧性資料,類器官藥敏檢測結果反映患者的臨床治療效果。團隊還用該藥敏篩選平台,為六例患者提供個體化治療指導建議,這些患者均取得良好的治療效果。
此研究提出了一套基於類器官模型藥敏篩查的全新乳腺癌精準治療策略,為腫瘤精準醫學提供了新方向,具重要的臨床意義。相關治療策略已獲國際頂級學術期刊《先進科學》(Advanced Science,影響因子為16.8)刊登。
激活免疫功能清除癌細胞
精準腫瘤學是澳大科研戰略佈局中的重點發展領域,大學積極謀劃、科學組織、發揮學科交叉的優勢,前沿科學中心匯聚了健康科學、中醫藥、物理與材料、科技工程等領域的跨學科團隊,融合頂尖技術,針對常見癌症進行深入的基礎研究。當中,碳量子點癌症免疫診療技術,是跨學科團隊最新的治癌方向。此研究運用一種基於碳量子點生物技術,能快捷、準確地將腫瘤特異性抗原,呈遞給人體免疫淋巴系統,並由此激活自身免疫系統對腫瘤的免疫反應,以自身的免疫力量清除癌細胞,進而達到治療腫瘤的效果。
國際知名的納米光電子材料領域領軍人物、應用物理及材料工程研究院院長湯子康教授表示,癌症之所以難治療,是因為癌症細胞能夠通過免疫逃逸機制,狡猾地逃脫免疫系統的追殺。他說:「我們跟鄧初夏教授的研究團隊,合作研究用一種無毒性、生物相容的碳量子點,對癌細胞的蛋白進行『整容』,令這些癌細胞蛋白不再與正常蛋白相似,從而被免疫細胞識別、吞噬、抗原呈遞,導致高效率的免疫反應。」
目前,相關科研成果正在申請發明專利,並積極推進臨床研究。鄧初夏教授說:「此跨領域研究成果不僅具有巨大的臨床應用及商業價值,也為癌症患者帶來新曙光。」
新型材料彌補放療缺陷
傳統的放射療法在治癌功效上得到認可,但卻存在一定的缺陷,如高劑量X射線對正常組織產生的毒性、腫瘤微環境對放療過程中的毒性物質產生抑制作用,限制了放療效果。針對此難點,健康科學學院、前沿科學中心助理教授代雲路團隊開發了新型材料Hb@Hf-Ce6納米粒子,能將氧氣直接載入深度腫瘤組織中,扭轉原本缺氧的腫瘤微環境,使X射線即使在低劑量條件下,仍能提高腫瘤細胞對放療的敏感度,同時此材料的金屬多酚配位結構,把重金屬離子引入放療過程中,透過產生長波長的光增強放動力療法,深層次強化放療效果,亦減輕毒性對人體的副作用。代雲路教授說:「在我們的實驗結果中表明這材料提高放療、放動力療法的成效,雙管齊下令癌細胞死亡。」
另外,代雲路教授團隊在Hb@Hf-Ce6納米粒子基礎上開發凝膠材料,用於手術後貼在腫瘤原位,透過材料持續釋放藥力,防止癌症轉移。他說:「此材料結構引入PD-1抗體蛋白,就能有效對遠端瘤、腫瘤細胞的肺轉移產生抑製作用。」目前,相關技術已在小鼠原位雙邊腫瘤模型中得以驗證,能高效長期抑制腫瘤生長和轉移。整個新型的治癌策略獲《先進科學》刊登。
抗腫瘤轉移新療法
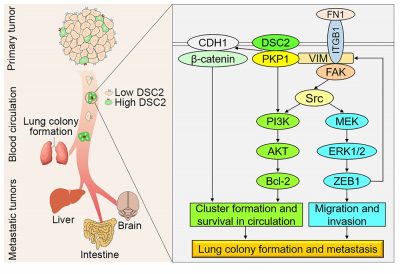
在抗癌路上,患者最不想聽到的消息恐怕是癌症轉移。當循環腫瘤細胞(CTC)嘗試從原位腫瘤擴散,跑到血管裡後,絕大多數都會像跳進急流似的、抵受不住血液循環中的物理剪切力而死亡,而存活下的CTC若能成功形成轉移瘤,會造成90%患者死亡。因此探究CTC如何在血液循環中存活並轉移,對開發新型抗癌轉移療法至關重要。健康科學學院、前沿科學中心教授羅茜團隊通過對分子機理的研究,發現了一系列分子靶標,如PKP1、DSC2等,能幫助CTC在循環系統中形成細胞團,從而增加其在血液循環衝擊下的存活率,並強化其轉移能力。
羅茜教授說:「循環腫瘤細胞在血管裡透過抱團取暖的方法,拼命的互相依附而活下來。PKP1、DSC2是細胞膜橋粒蛋白,當這些橋粒蛋白多了,CTC之間就可以聯合在一起。這樣粘合不是簡單的挨著,而是說它們真的抱在一起,就如竹筏渡河一樣,這樣CTC存活率明顯提升。」此研究發現為CTC如何在循環系統中存活提供了嶄新見解。PKP1、DSC2的高表達與腫瘤惡性程度呈正相關,兩者也可以在乳腺癌和肺癌患者的腫瘤樣本中被檢測到,並顯示DSC2和PKP1可作為檢測轉移性CTC的新型生物標誌物和治療新靶點。此研究成果已獲國際著名期刊《科學進展》(Science Advances,影響因子為14.14)刊登。
精準切除衛星腫瘤
腫瘤的主要病灶周邊常有微小、不易辨識的衛星腫瘤,醫生在手術中難以辨識切除,而傳統成像系統,如電腦斷層攝影(CT)或磁振造影(MRI),也沒有辦法看到這些微小的腫瘤。有見及此,健康科學學院、前沿科學中心副教授劉子銘的研究團隊利用腫瘤微環境的缺氧特性,研發出創新的影像量測方法「氧氣磷光探針技術」,透過氧氣成像方法鑑別腫瘤附近有否漏網之魚。劉子銘教授說:「衛星腫瘤殘留體內,始終會對健康構成嚴重的威脅。這螢光探針只要打進組織裡,就能在組織缺氧的地方發出放光信號,提示微小腫瘤潛藏的位置,但凡有發光的部份都需要切除,這樣就能協助醫生精準切除未能被醫學影像偵測的腫瘤。」
此螢光分子探針使用簡單方便,無需預先封裝或用樹枝狀分子作修飾,只需透過靜脈注射方式,直接把這光學探針注射到血液循環。當探針從血管中穿透而出,與血管周邊的膠原纖維結合,就能使組織本身成為光學讀取式的氧氣濃度計。團隊已進行了多項活體試驗,顯示磷光探針能超過六小時連續監測氧氣濃度變化,具有良好的穩定性,並能準確偵測出具缺氧特性的腫瘤。相關成果已獲《先進科學》刊登。
來源:《澳大人》電子版