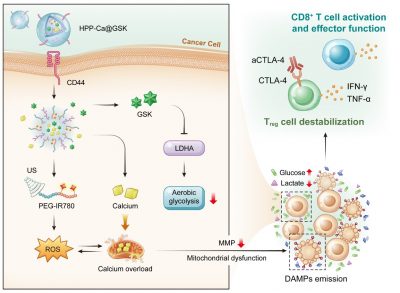
澳門大學健康科學學院副教授代雲路帶領的團隊在腫瘤免疫治療領域取得了重要的研究進展。該研究構建一種新型金屬-多酚納米藥物,通過結合超聲介導的氧化應激和有氧糖酵解抑製劑來調控腫瘤細胞的代謝功能。這種“聲-代謝”療法有助於重新編程腫瘤微環境,從而提高腫瘤微環境中T細胞的抗腫瘤免疫效應,。相關研究成果已發表在材料領域知名期刊《ACS Nano》上。
對於腫瘤細胞和免疫細胞而言,細胞代謝是維持其活力和功能的關鍵因素。即使是在氧氣充足的條件下,腫瘤細胞依然具有通過糖酵解分解葡萄糖產生乳酸的能力,該效應被稱為“有氧糖酵解”,被認為是惡性腫瘤的重要特徵。研究發現,腫瘤微環境中的具有高代謝活性的腫瘤細胞會與免疫細胞對周圍有限的營養物質進行爭奪。腫瘤細胞的這種高葡萄糖攝取和乳酸產生的能力,不僅剝奪了CD8+ T細胞的能量來源,抑制其效應功能,而且有助於維持調節性T細胞的高免疫抑制能力。
有鑑於此,研究團隊開發了一種新型金屬-多酚納米藥物HPP-Ca@GSK,通過聲-代謝療法來誘導線粒體功能障礙和腫瘤微環境重編程。具體而言,該團隊引入了LDHA抑製劑GSK2837808A來抑制腫瘤細胞有氧糖酵解,重建高葡萄糖、低乳酸的腫瘤微環境,這有利於提高CD8+ T細胞的效應功能和調節性T細胞的不穩定性。此外,超聲介導的氧化應激促使線粒體鈣離子過載,放大了線粒體功能障礙,從而促進損傷相關的分子模式釋放。這有助於促進樹突狀細胞的成熟和CD8+ T細胞的激活,使得更多活化的CD8+ T細胞浸潤到腫瘤部位。最後,與aCTLA-4抗體聯用會進一步增強調節性T細胞的不穩定性,提高聲-代謝腫瘤治療的療效。
此次研究的通訊作者為代雲路和澳門大學健康科學學院研究助理教授李蓓,共同第一作者為學院博士生顏潔、研究助理李文曦和博士生田浩。博士生余馨穎、博士畢業生王國浩和桑瑋也對該研究做出重要貢獻。學院基因組學、生物信息學及單細胞分析核心實驗中心、動物研究核心實驗中心及生物成像及幹細胞核心實驗中心亦為研究提供了大力支持。此項研究由國家自然科學基金(檔案編號:32222090、32171318和32101069)、澳門大學(檔案編號:MYRG2022-00011-FHS)、澳門特別行政區科學技術發展基金(檔案編號:0103/2021/A、0002 /2021/AKP和0133/2022/A3)、深港澳科技計劃C類項目(檔案編號:SGDX20201103093600004)、何鴻燊博士醫療拓展基金會(檔案編號:SHMDF-OIRFS/2022/002)和澳門大學教育部精準腫瘤學前沿科學中心(SP2023-00001-FSCPO)資助。研究文章的完整版本可瀏覽https://pubs.acs.org/doi/full/10.1021/acsnano.3c02428。