澳門大學健康科學學院副教授趙琦帶領的團隊,在針對靶向三陰性乳腺癌(TNBC)的納米藥物的開發方面取得了重要進展。他們通過金屬離子介導的配位自組裝策略成功製備了近紅外第二視窗(NIR-II,1000-1700 nm)光激發的納米藥物,該藥物通過適配體介導的主動靶向可以實現TNBC的NIR-II光學診療,同時放大銅離子介導的氧化應激和銅死亡,提高對於TNBC的治療效率。該研究已發表於國際學術期刊《Chemical Engineering Journal》上
化療作為目前臨床上TNBC的主要治療方式,由於非特異性的藥物分佈引發的毒副作用,未能改善乳腺癌患者的生活品質。因此,開發一種非侵入性、時空可控的腫瘤靶向治療策略對於TNBC治療具有重要意義。NIR-II光學診療技術,特別是NIR-IIa(1300-1400 nm)子視窗的螢光成像,由於來自生物樣品的光子吸收和散射減小,能夠實現更深的組織穿透深度和更高的最大允許輻照能量,在非侵入性的乳腺癌診療中顯示出巨大的應用前景。
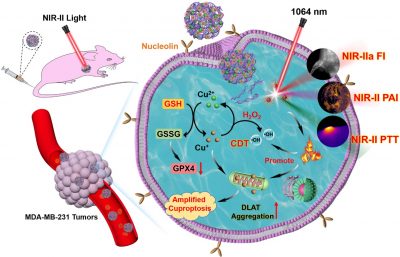
銅死亡是一種發生在三羧酸 (TCA) 循環中的銅誘導細胞死亡途徑,涉及線粒體脂醯化蛋白聚集,並伴有鐵-硫 (Fe-S) 簇蛋白的流失,產生高的蛋白毒性應激並最終導致細胞死亡。此外,銅離子可以通過類芬頓反應誘導腫瘤組織中羥基自由基(·OH)的產生,成為化學動力學治療(CDT)的氧化應激誘導劑。然而,腫瘤細胞內的谷胱甘肽的銅螯合、銅離子的容易外排以及缺乏靶向的銅輸運可能會削弱銅基治療效果。近年來,核酸自組裝的分子工程化因其高的親和力和特異性而被提出用於基因干擾治療和靶向治療,有望成為銅離子靶向遞送至腫瘤的潛在候選者。
鑒於此,研究團隊利用Cu(II)作為配位節點,通過靶向適配體(AS1411)的自組裝和後續的超小NIR-II半導體聚合物點(Pdots)的表面塗覆製備得到NIR-II光激發的納米藥物(ACP NPs),用於銅離子的靶向自遞送。通過適配體對腫瘤細胞表面核仁素的特異性識別,ACP NPs可以主動靶向TNBC細胞。負載在納米藥物中的Pdots在NIR-II光激發下能夠實現NIR-IIa螢光/NIR-II光聲成像引導的光熱治療。此外,腫瘤細胞內過表達的GSH和高含量的的鐵氧還蛋白 1 (FDX1) 可將細胞中的Cu(II) 還原為細胞毒性的Cu(I)。Cu(I)不僅可以催化內源性過氧化氫(H2O2)生成•OH以實現有效的CDT,而且可以與線粒體內的脂醯化成分結合,導致二氫脂醯胺S-乙醯基轉移酶(DLAT)的異常聚集,從而通過蛋白毒性應激誘導銅死亡。而且,NIR-II光熱效應和GSH消耗可以進一步放大銅介導的氧化應激和銅死亡的治療效果,從而提高對於TNBC的治療效率。mRNA轉錄組分析進一步證實了銅基治療誘導的線粒體損傷。這項工作為針對TNBC的靶向多模態診療提供了一種有前景的策略。
該項研究的通訊作者為趙琦,澳大博士後戴葉能為第一作者。澳大健康科學學院的博士生冷棟樑、郭子昂、王佳琪、顧宇恒和彭穎君及博士後朱里鵬也對這項研究做出了重要的貢獻。此項研究獲澳門科學技術發展基金(檔案編號:FDCT/0043/2021/A1和FDCT/0002/2021/AKP),國家重點研發計畫(檔案編號:2019YFA0904400)和澳門大學(檔案編號:MYRG2022-00143-FHS)資助。